АНТИТУБУЛИНИ В ТЕРАПИЯТА НА СЪРДЕЧНОСЪДОВИ БОЛЕСТИ:
БЪЛГАРСКИЯТ ПРИНОС *
Георги Н. Чалдъков
Катедра по анатомия и клетъчна биология, Медицински университет, Варна
Кореспонденция: chaldakov@yahoo.com
Кратко заглавие: Колхицин и сърдечносъдови болести
Абстракт
Медицинската история на есенния минзухар (Colchicum autumnale) е описвана от преди хиляди години като лекарство, облекчаващо силните болки от остър артрит при хора с подагра. Напредъкът в познанията за (i) цитоскелетните микротубули (МТ) и (ii) клетъчните ефекти на колхицина откри нови терапевтични приложения на това много старо лекарство. Тук представям накратко българския принос към възможния потенциал на разграждащи МТ химически вещества (антитубулини), като колхицин, за терапията на сърдечносъдови болести – остри коронарни синдроми, периферна атеросклероза, предсърдно мъждене, перикардит, системен некротизиращ васкулит, сърдечна недостатъчност, свързана с миокардна хипертрофия, и исхемичен инсулт.
Ключови думи: колхицин, микротубули, антитубулини, терапия, сърдечносъдови белести, възпаление, фиброза
Въведение
Сагата на Colchicum autumnale (есенен минзухар) е описвана от преди хиляди години като лекарство, облекчаващо силните ставни болки при подагра. Днес е известно, че този лечебен ефект се дължи на противовъзпалителното действие на колхицина, изолиран преди повече от 100 години от Colchicum autumnale. През последните 30-40 години обаче колхицинът също се използва и за лечение на фамилна средиземноморска треска (и свързаните с нея амилоидоза и рецидивиращ перикардит), болест на Behçet, остра фебрилна неутрофилна дерматоза (синдром на Sweet), епидермолиза булоза, афтозен стоматит, също така – цироза на черния дроб, склеродермия и други фибро-възпалителни болести (1, 2).
Микротубули и колхицин
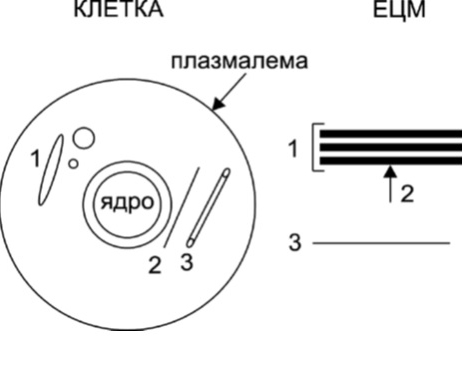
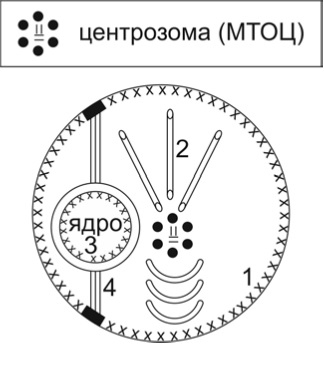
Цитоплазмените микротубули (МТ) и тези на митотичното делително вретено са динамични структури, изградени от протеини, които се асемблират и дезасемблират според физиологията на клетките. Те са неоградени с мембрана тръбести образувания с външен диаметър 25 nm – вътрешен диаметър 15 nm, дебелина на стената 5 nm. Стената на МТ е изградена от 13 протофиламента, съставени от α-тубулин и β-тубулин, асемблирани надлъжно с участието на МТ-асоциирани протеини (МАП 1-7 и tau протеин). Микротубулите се свързват с моторните протеини кинезин и динеин при транслокацията на (i) мембранооградени структури (например, синаптични везикули и секреторни вакуоли) и (ii) хромозоми по време на митотично делене. Микротубулите се „раждат“ от МТ-организиращ център, съставен от центрозома и перицентрозомен материал, формиращ гама-тyбулинови пръстовидни комплекси (γ-tubulin ring complexes – γ-TuRC), разположени в транс-Голджи зоната (2а; Фиг. 1, 2).
Матриксни структури
1 фибра
2 фибрила
3 филамент
базална ламина
Органели протеогликанови мрежи
Мембранооградени (1)
- ядро
- цистерни, вакуоли, везикули
- ендоплазматичен ретикулум
- комплекс на Голджи
- митохондрии
- други
Неоградени с мембрана
- цитоскелетон
- филаменти (2)
- микротубули (3)
––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
Фигура 1. Основни клетъчни органели и матриксни структури. Плазмалемално-цотоскелетните органели и някои матриксни структури не са отразени на фигурата. ЕЦМ, екстрацелуларен матрикс. От: (2a).
––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
Фигура 2. Схема на микротубул-организиращ център, изграден от центрозома, съставена от две центриоли (=) и перицентриоларен материал (γ-tubulin ring complexes) (•), разположен в транс зоната на комплекса на Голджи ( 1). Mикротубули (2), нуклеарна ламина (3ххх), интермедиерни филаменти (4), субплазмалемален скелетон (ххх).
–––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
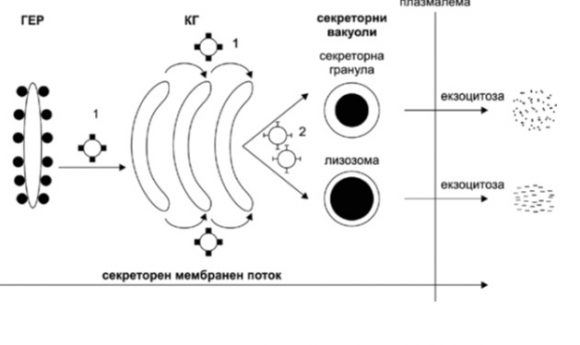
Колхицинът се свързва с β-тубулин, което води до инхибиране на образуването на МТ и/или разрушаване (дезасемблиране) на формираните МТ. Така, колхицинът може да инхибира различни МТ-зависими клетъчни функции и процеси, например: (i) в интерфазни клетки – протеинова секреция, включително тази на колаген и други матриксни протеини (1-10; Фиг. 3-6), NLRP3 инфламазоми-медиирано възпаление* и (ii) в делящи се клетки – пролиферация. Последната не е обект на настоящата статия – MT-раграждащи вещества (vinblastine и vincristine) и MT-стабилизиращи вещества (paclitaxel/taxol) са примери за антитуморни лекарства.
Фигура 3. Схема, представяща секреторен мембранен поток на протеини (секреция на протеини, включително фиброгенни протеини). Обърнете внимание на локализацията на COP (coated protein) везикулите (1) и клатрин-облечените везикули (2). ГЕР – гранулиран ендоплазматичен ретикулум; КГ – комплекс на Голджи. Секреторният поток е антерограден, кинезин-зависим – от ГЕР през КГ до плазмалемата. От: (2а).
–––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
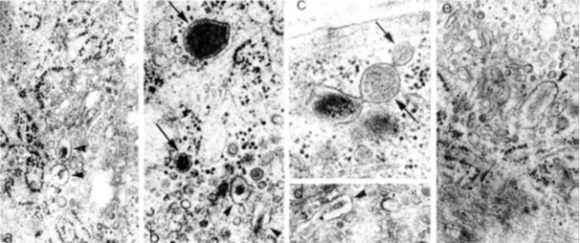
Фигура 4. Електронно-микроскопски микрографии на секреторен фенотип васкуларни гладкомускулни клетки на експериментални животни. a-e. Посочени са секретопни вакуоли със сферична(стрелки) и елонгирана (глави на стрелки) форма. x 20 000. От: (8).
–––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
Фигура 5. Електронно-микроскопски микрографии на секреторен фенотип васкуларни гладкомускулни клетки на експериментални животни. a. Асоциирани с комплекса на Голджи клатрин-облечени везикули (стрелки). b. Елонгирана вакуола, свързана с микротубул чрез къси филаментозни структури (две стрелки). c. Произхождащ от плазмалемата клатрин-облечен везикул (три стрелки). d. Група от Голджиеви везикули, разположени между микротубули. e. Микротубули, асоциирани с гранулиран ендоплазматичен ретикулум. a, c, d x 50 000; b x 80 000; e x 20 000. От: (8).
Фигура 6. Електронно-микроскопски микрографии на секреторен фенотип васкуларни гладкомускулни клетки на експериментални животни, третирани с субантимитотични дози колхицин. Клетките отговарят на третирането с (a) натрупване на секреторни гранули (посочени в кръгове) или (b) вакуоларен тип дилатация на цистерните на гранулирания етдоплазматимен ретикулум, някои от които достигат до плазмалемата (1, 2, 3). a, b x 10 000. От: (8).
Българският принос
Концепцията за възможния терапевтичен потенциал на МТ- дeзасемблиращи агенти (антитубулини), като колхицин, се появи през 1970-те години в Лабораторията по електронна микроскопия на Медицинския институт във Варна, изучаваща секреторната функция на васкуларни гладкомускулни клетки (3, 4, 6-9). Първото международно представяне на резултатите за тази концепция беше в лекцията, изнесена от автора на Международния симпозиум за гладката мускулатура на артериите, проведен през 1975 г. в Хайделберг, Германия, публикувана през 1975 г. (3; виж също 1, 4-15).
От тази година нататък концепцията за антитубулините и лечението на сърдечносъдовите болести е подкрепяна многократно (16-26). Доказано е също, че увеличеният брой на МТ в кардиомиоцитите има значима стойност за миокардната контрактилна дисфункция (27, 28). Авторите предположиха, че това може да бъде един от механизмите, допринасящи за развитието на сърдечна недостатъчност, базирана на сърдечна хипертрофия, и съответно колхицинът възстановява контрактилната активност на кардиомиоцитите (виж също 11, 29).
Заключение
Ефективността на ниски дози колхицин (от low doses colchicine, наричан LoDoCo) – орално в субантимитозни дози от 0.5 – 1.0 mg/дневно – се превръща в значим компонент на терапевтичния армаментариум за сърдечносъдовите болести. По-нататъшни експериментални и клинични проучвания ще бъдат необходими, преди да се достигне окончателното доверие в антитубулиновата терапия на тези болести. Колхицинът е само един пример за този подход. Той може да доведе до откриването на нови антитубулини с анти-възпалителни и анти-фиброзни ефекти при сърдечносъдовите заболявания, включително коронарната реоклузия след ангиопластика на коронарните артерии.
Трябва обаче да си припомняме стиховете на Робърт Фрост:
Ние танцуваме в кръг и предполагаме,
но тайната стои в средата и знае.
–––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
* Nucleotide-binding oligomerization domain-like receptors, pyrin domain-containing 3 (NLRP3) inflammasome е цитоплазмен протеинов комплекс-сензор за патогенна инвазия. Той активира caspase-1 (cysteine-aspartic protease), която превръща pro-interleukin (IL)-1ẞ и pro-IL-18 в, съответно, IL-1ẞ и IL-18 – мощни про-инфламаторни цитокини (26, 30 за колхицин и NLRP3 инфламазоми; 31 за Canakinumab – човешко моноклонално антитяло, неутрализиращо дейстивето на IL-1ẞ, продукцията на който се увеличава в клетки с холестеролови кристали, и участва в патогенезата на остри коронарни синдроми и исхемични инсулти. Canakinumab Anti-inflammatory Thrombosis Outcomes Study (CANTOS) са клинични опити на пациенти остра коронарна атеросклероза, които имат персистиращи високи нива на възпалителния биомаркер hsCRP (≥2mg/L). Важно – и от финансов аспект – тревожно, лечението със Canakinumab е хиляди пъти по-скъпо, отколкото това с колхицин.
Благодарности
Този български принос стана възможен благодарение на творческото сътрудничество през годините с моите Brain-and-Heart Friends (BHF): Анна Кадар, Хари Иелинек, Петър И. Генев, Йорг Грюнвалд, Ясуо Уехара, Юкио Ямори, Такаши Фудживара, Торо Набика, Пламен Панайотов, Антон Б. Тончев и Станислав Янев. Благодарности на проф. Денис Уитли (Университета в Абърдийн, Великобритания) за лингвистичното подобрение на ръкописа. Извинявам се на авторитe, чиито статии не цитирах, заради краткост на статията.
* Статията е публикувана в декемврийския брой на БГ Наука, 2017
–––––––––––––––––––––––––––––––––––––––––––––––––––-
Цитирана литература
- Chaldakov GN, Deyl Z, Vankov VN. Colchicine: possible new application of its antifibrotic (antisecretory) action. Physiol Bohemoslov 1987;36:1-7.
- Solak Y, Siriopol D, Yildiz A, Yilmaz MI, Ortiz A, Covic A, et al. Colchicine in renal medicine: New virtues of an ancient friend. Blood Purif 2017;43:125-135. DOI: 10.1159/000454669
. 2а. Чалдъков ГН. Клетъчна биология. Второ издание. Университетско издателство. Медицински университет, Варна. 2014.
- Chaldakov GN, Nikolov SD. Ultrastructure of the arterial smooth muscle cell. In: Wolf S, Werthessen NT, editors. The Smooth Muscle of the Artery. New York City, NY: Plenum Press. Adv Exp Med Biol 1975; 57:14-
- Chaldakov G, Nikolov S, Vankov V. Fine morphological aspects of the secretory process in arterial smooth muscle cells. Part 2. Role of microtubules. Acta Morph. Acad Sci Hung 1977; 25:167-174.
- Chaldakov GN, Kadar A. Microtubules in arterial smooth muscle cells in vivo and in tissue culture. An electron microscope study. In: W. Hauss, R. Wissler, R. Lehman, editors. State of Prevention and Therapy of Human Arteriosclerosis and in Animal Models. Rheinisch-Westfalische Akad. Der Wissenschaften, 1978, p. 211-231
- Chaldakov GN, Nikolov S, Vankov Can antitubuhns be antiatherosclerotic agents? A hypothesis based on electron microscope data [abstract]. In: 6th Hungarian Atherosclerosis Conference, Dobogoko, 10-12 September, 1981, p. 11A.
- Chaldakov GN. Antitubulins – a new therapeutic approach for atherosclerosis? Atherosclerosis 1982; 44: 385-390
- Chaldakov GN, Vankov VN. Morphological aspects of secretion in the arterial smooth muscle cell, with special reference to the Golgi complex and microtubular cytoskeleton. Atherosclerosis 1986;61:175-192.
DOI: 1016/0021-9150(86)90137-1 - Chaldakov GN, Vankov VN. Antifibrotic approach in the therapy of arterial occlusive diseases: new considerations. In: G. Trubestein, editor. Conservative Therapy of Arterial Occlusive Disease. Stuttgart, New York, Georg Thieme Verlag, 1986, p. 224-226.
- Chaldakov GN, Grünwald J. Effect of colchicine on the ultrastructure of secretory-state smooth muscle cells from the rabbit artery wall. Exp Pathol 1987;31:1-9.
. 11. Chaldakov GN, Nabika T, Nara Y, Yamori Y. Cyclic AMP- and cytochalasin B-induced arborization in cultured aortic smooth muscle cells: its cytopharmacological characterization. Cell Tissue Res 1989;255:435-442. PMID: 2538239
- Chaldakov GN. Anti-inflammatory drugs and ischemic heart disease: new considerations (a cell biologist’s proposal to cardiologists). J Am Coll Cardiol 1991;17:1445-144
- Chaldakov GN. Proposal for clinical trials using anti-inflammatory drugs in the therapy of angina pectoris, myocardial infarction and coronary restenosis after angioplasty and bypass grafting. Med Hypotheses 1992;37:74-75.
- Yanev S, Fiore F, Hinev A, Ghenev PI, Hristova MG, Panayotov P, et al. From antitubulins to trackins. Biomed Rev 2016; 27: 59-67.
- Chaldakov GN, Kisheva AR, Ghenev P. Quo vadis, atherogenesis? Part 1. Smooth muscle cell secretion – may foe become friend in the fight against the vulnerable atherosclerotic plaque. Biomed Rev 2017; 28: in press.
- Vaidya K,Arnott C, Martínez GJ, Ng B, McCormack S, Sullivan DR, et al. Colchicine therapy and plaque stabilization in patients with acute coronary syndrome: A CT Coronary Angiography Study. JACC Cardiovasc Imaging 2017. DOI: 10.1016/j.jcmg.2017.08.013
- Lennerz C, Barman M, Tantawy M, Sopher M, Whittaker P. Colchicine for prevention of post-cardiac procedure atrial fibrillation: Meta-analysis of randomized controlled trials. Int J Cardiol 2017;249:127-137. DOI: 10.1016/j.ijcard.2017.08.039
- Salih M, Smer A, Charnigo R, Ayan M, Darrat YH, Traina M, et al. Colchicinefor prevention of post-cardiac procedure atrial fibrillation: Meta-analysisof randomized controlled trials. Int J Cardiol 2017;243:258-262. DOI: 10.1016/j.ijcard.2017.04.022
- Hemkens LG, Ewald H, Gloy VL, Arpagaus A, Olu KK, Nidorf M, et al. Cardiovascular effects and safety of long-term colchicine treatment: Cochrane review and meta-analysis. Heart 2016;102:590-59 DOI: 10.1136/heartjnl-2015-308542
- Lee JZ, Singh N, Howe CL, Low S-W, Huang JJ, Ortega G, et al.Colchicine for prevention of post-operative atrial fibrillation. J Am Coll Cardiol Clin Electrophysiol.2016; 2:78–85. DOI:10.1016/j.jacep.2015.09.016
. 21. Campbell KB, Cicci TA, Vora AK, Burgess LD. Beyond gout: Colchicine use in the cardiovascular patient. Hosp Pharm 2015;50:859-867 DOI: 10.1310/hpj5010-859
- Nidorf SM, Eikelboom JW, Budgeon CA, Thompson PL. Low-dose colchicine for secondary prevention of cardiovascular disease. J Am Coll Cardiol 2013;61:404-4 DOI: 10.1016/j.jacc.2012.10.027
- Vogel RA, Forrester Cooling off hot hearts: A specific therapy for vulnerable plaque? J Am Coll Cardiol 2013; 61:411-412. DOI: 10.1016/j.jacc.2012.10.026
- Alsarah A, Alsara O, Laird-Fick Cardiac manifestations of Familial Mediterranean fever. Avicenna J Med 2017; 7: 158–163. DOI: 10.4103/ajm.AJM_78_17
- Antonopoulos AS, Papanikolaou E, Vogiatzi G, Oikonomou E, Tousoulis D. Anti-inflammatory agents in peripheral arterial disease. Curr Opin Pharmacol 2017;39:1-8. DOI: 10.1016/j.coph.2017.11.001
- Martınez GJ, Robertson S, Barraclough J, Xia Q, Mallat Z, Bursill C, et al. Colchicine acutely suppresses local cardiac production of inflammatory cytokines in patients with an acute coronary syndrome. J Am Heart Assoc 2015;4:e002128. DOI: 10.1161/JAHA.115.002128
- Cheng G, Kasiganesan H, Baicu CF, Wallenborn JG, Kuppuswamy D, Cooper G 4th. Cytoskeletal role in protection of the failing heart by β-adrenergic blockade. Am J Physiol Heart Circ Physiol 2012;302:H675-H687. DOI: 1152/ajpheart.00867.2011
- Cheng G, Takahashi M, Shunmugavel A, Wallenborn JG, DePaoli-Roach AA, Gergs Y, et al. Basis for MAP4 dephosphorylation-related microtubule network densification in pressure overload cardiac hypertrophy. J Biol Chem 2010; 285: 38125–38140. DOI:1074/jbc.M110.148650
- Dybkova N, Wagner S, Back J, Hund TJ, Mohler PJ, Sowa T, et al. Tubulin polymerization disrupts cardiac β-adrenergic regulation of late INa. Cardiovasc Res 2014;103:168-1 DOI: 10.1093/cvr/cvu120
- Robertson S, Martinez GJ, Payet CA, Barraclough JY, Celermajer DS, Bursill C, et al. Colchicine therapy in acute coronary syndrome patients acts on caspase-1 to suppress NLRP3 inflammasome monocyte activation. Clin Sci (Lond) 2016; 130:1237-12 DOI: 10.1042/CS20160090
- Ridker PM, Howard CP, Walter V, Everett B, Libby P, Hensen J, et al; Group Effects of interleukin-1beta inhibition with canakinumab on hemoglobin A1c, lipids, C-reactive protein, interleukin-6, and fibrinogen: a phase Iib randomized, placebo-controlled trial. Circulation 2012;126:2739-2748.
.